セロイドリポフスチン症2型治療剤
ブリニューラ®
ブリニューラ®(セルリポナーゼ アルファ)は、セロイドリポフスチン症2型に対する酵素補充療法製剤です。

ブリニューラ®の概要1
ブリニューラ®(セルリポナーゼ アルファ)は、セロイドリポフスチン症2型に対する酵素補充療法製剤です。
承認情報
- 承認
- 年月日
- 希少疾病用医薬品指定年月日
- 2018年9月14日(指定番号:第420号)
- 製造販売承認年月日
- 2019年9月20日
- 販売開始(薬価収載)年月日
- 2020年1月6日
効能又は効果
セロイドリポフスチン症2型
用法及び用量
通常、セルリポナーゼ アルファ(遺伝子組換え)として、300㎎を2週間に1回、脳室内投与する。なお、患者の状態、年齢に応じて適宜減量する。
用法及び用量に関連する注意
2歳未満の患者では、下表を参考に減量すること。
- 年齢
- 1回投与量
- 出生~生後6カ月未満
- 100mg
- 生後6カ月~1歳未満
- 150mg
- 1歳~2歳未満
- 初めの4回目までの投与量:200 mg
5回目以降の投与量:300 mg
製剤写真
ブリニューラ®の有効性2
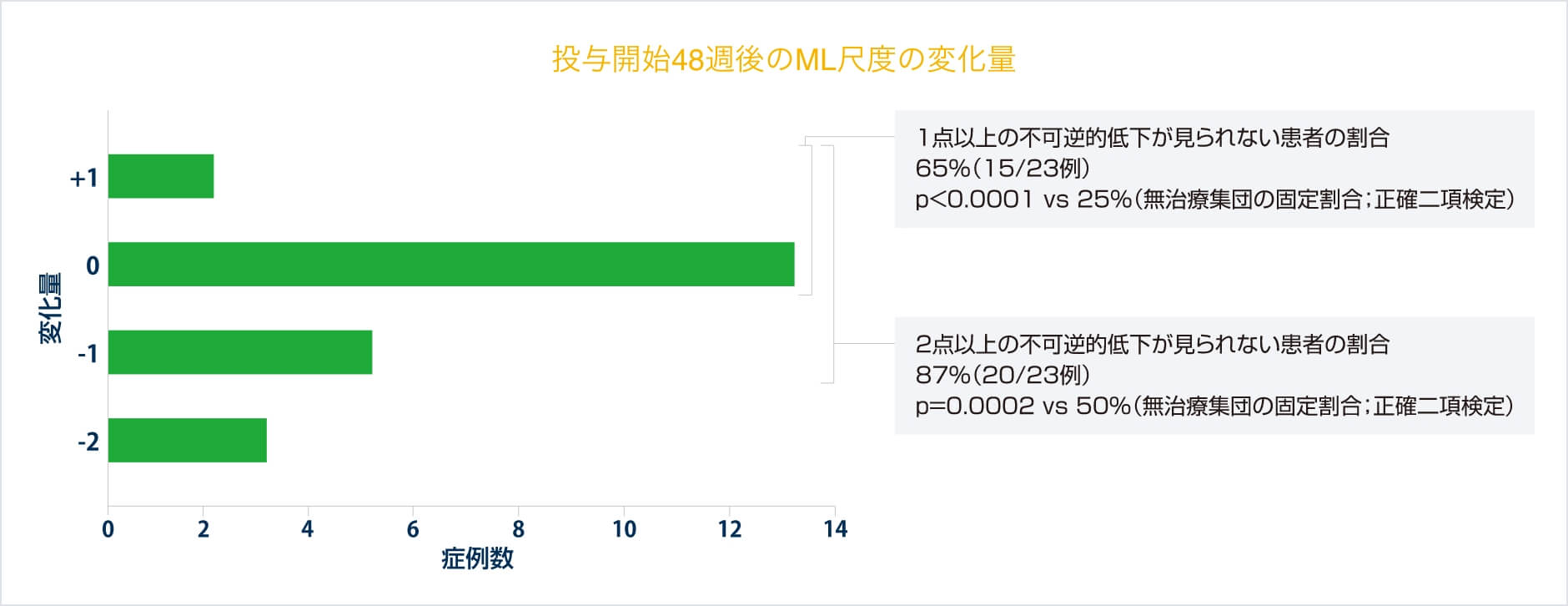
レスポンダー解析(190-201/202試験、主要評価項目)
48週時(300mg投与開始から340日)におけるレスポンダーの割合は87%(20/23例)(95%信頼区間:66〜97%)であり、無治療の自然経過患者の固定割合である50%を有意に上回った(p=0.0002、正確二項検定)。また、投与開始48週時において1点以上の不可逆的低下が見られない割合は65%(15/23例)であり、無治療の自然経過患者の固定割合である25%を有意に上回った(p<0.0001、正確二項検定)。
96週時(190-201試験の固定用量投与期の300mg投与開始から679日)におけるレスポンダーの割合は87%(20/23例)(95%信頼区間:66〜97%)であり、無治療の自然経過患者の固定割合である50%を有意に上回った(p=0.0002、正確二項検定)。
レスポンダーの定義
- ML尺度(0〜6点)がベースライン(300mg投与開始時)から2点以上の不可逆的低下が見られない(ベースラインからのML尺度が1点低下、不変又は改善)
- ベースラインのML尺度が1点であった場合、0点とならない
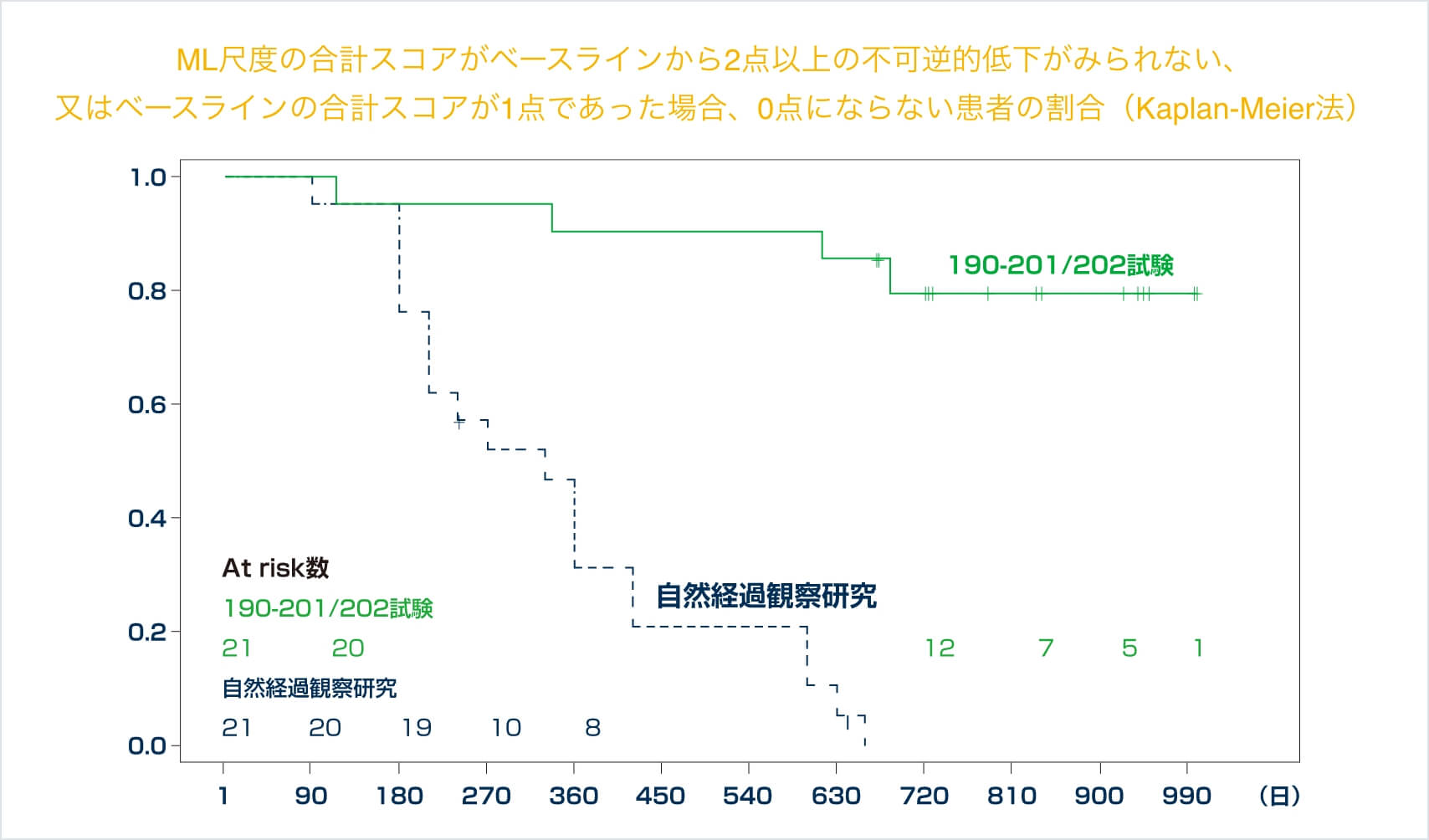
ML尺度の合計スコアがベースラインから2点以上の不可逆的低下がみられない、又はベースラインの合計スコアが1点であった場合、0点にならない患者の割合(190-201/202試験、自然経過観察研究との比較)
190-201/202試験と3歳以上のセロイドリポフスチン症2型患者における自然経過観察研究※との臨床評価尺度を比較検討した。190-201/202試験と類似した集団の自然経過観察研究の結果を比較したときのKaplan-Meier法により推定されたML尺度の合計スコアがベースラインから2点以上の不可逆的低下がみられない、又はベースラインの合計スコアが1点であった場合、0点にならない患者の割合は以下のとおりであり、ハザード比[95%信頼区間]は0.05[0.01, 0.18]であった(Cox比例ハザードモデル)。
※190-901試験3
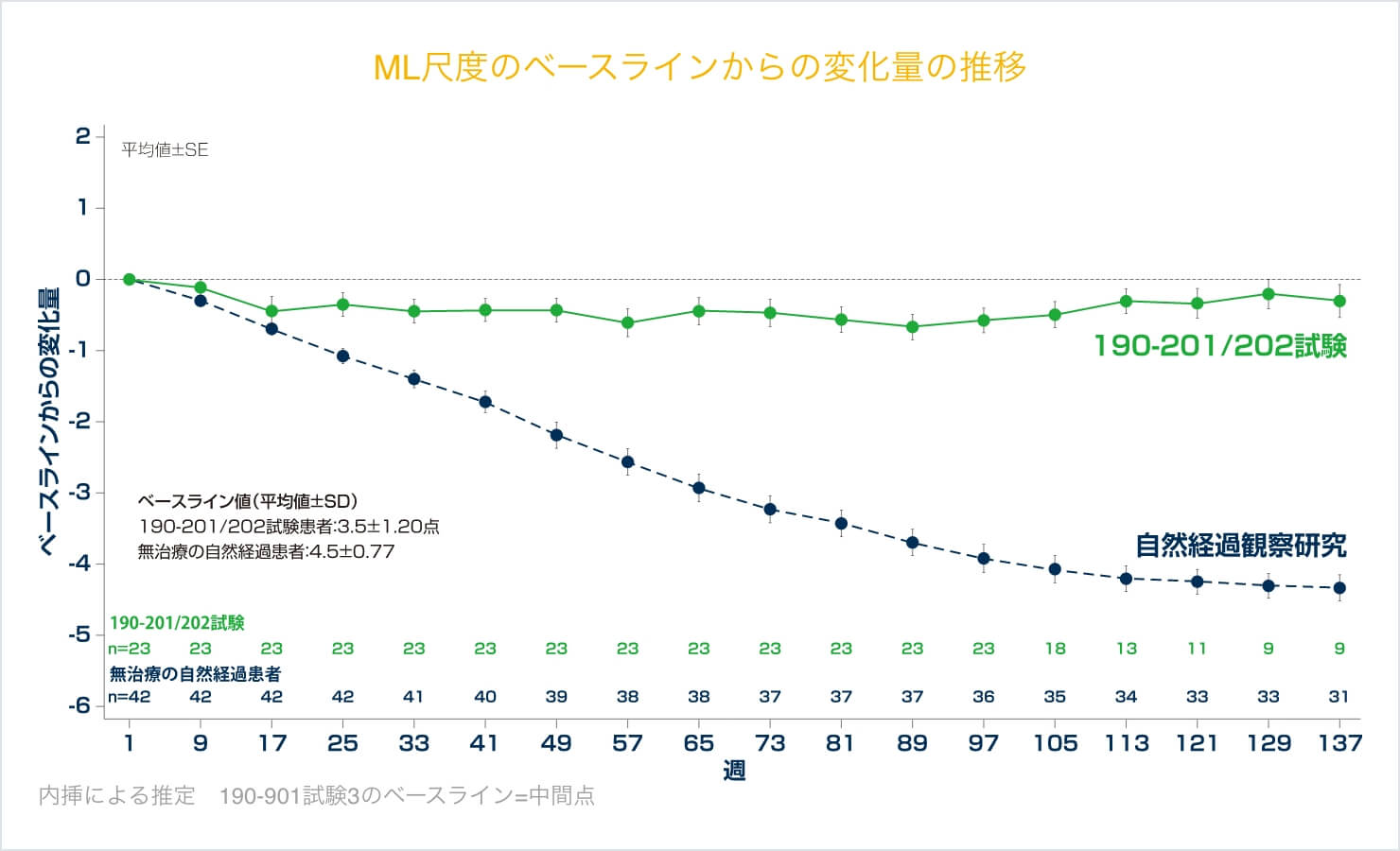
ML尺度の変化量(190-201/202試験、自然経過観察研究との比較)
190-201/202試験と3歳以上のセロイドリポフスチン症2型患者における自然経過観察研究※との臨床評価尺度の経時的変化を比較した。投与開始48週時における190-201/202試験患者でのベースラインからの変化量は-0.4±0.79点(平均値±SD、以下同様)であり、無治療の自然経過患者※のベースラインからの変化量は-2.2±1.09点であった。投与開始72週時での変化量は190-201/202試験患者で-0.5±0.89点、無治療の自然経過患者で-3.2±1.15点であり、投与開始96週時では190-201/202試験患者で-0.6±0.80点、自然経過患者で-3.9±1.13点であった。
※190-901試験3
ブリニューラ®の安全性3
190-201試験
有害事象は24例中24例(100%)で認められた。主な有害事象(発現率30%以上)は痙攣発作14例(58%)、発熱13例(54%)、てんかん11例(46%)、嘔吐11例(46%)、上気道感染10例(42%)、過敏症8例(33%)であった。
副作用は24例中23例(96%)で認められた。主な副作用(発現率30%以上)は発熱11例(46%)、過敏症及び痙攣発作 各8例(各33%)であった。
日本人患者1例では有害事象が18件(痙攣発作12件、過敏症3件、嘔吐、髄液細胞増加症及び上気道感染 各1件)認められ、このうち過敏症3件及び嘔吐1件は副作用と判断された。
重篤な有害事象※はコホート1の1例(過敏症/過敏症)、コホート2の3例(過敏症(日本人)、過敏症/過敏症/胃腸炎/肺炎/細菌性咽頭炎、注入に伴う反応/注入に伴う反応/発熱/膣分泌物)、コホート3の3例(齲歯、過敏症/細菌性咽頭炎、頭蓋内出血/不全片麻痺)、固定用量投与期から本剤が投与開始された9例(睡眠時無呼吸症候群、クロストリジウム・ディフィシレ大腸炎、硬膜下血腫、てんかん、過敏症、ウイルス性咽頭炎、てんかん/ライノウイルス感染/過敏症、運動機能障害/咽頭炎/プロピオニバクテリウム感染、発熱/インフルエンザ)認められ、このうちコホート1の1例(過敏症/過敏症)、コホート2の3例(過敏症(日本人)、過敏症/過敏症、注入に伴う反応/注入に伴う反応)、コホート3の1例(過敏症)、固定用量投与期から本剤が投与開始された2例(過敏症、過敏症)で認められた事象は副作用と判断された。
投与中断に至った有害事象は、コホート2の1例(医療機器機能不良/注射針の問題)及び固定用量投与期から本剤が投与開始された4例(痙攣発作、医療機器関連合併症、プロピオニバクテリウム感染及び発熱 各1例)の300mg投与時に認められ、このうち固定用量投与期から本剤が投与開始された1例(発熱)で認められた事象は副作用と判断された。
死亡例は認められなかった。
抗セルリポナーゼ アルファ抗体は、CSF中及び血清中のそれぞれについて24例中5例(21%)及び19例(79%)で、いずれかの評価時点で陽性となった。CSF中における本薬に対する中和抗体は、いずれの患者においても検出されなかった。
バイタルサイン及び12誘導心電図について、臨床的に意味のある変化は認められなかった。
※重篤な有害事象は、本剤投与開始前の脳室内投与用デバイス植込み手術後の回復期間中に発現した事象(コホート3の1例で認められた頭蓋内出血及び固定用量投与期から本剤が投与開始された1例で認められた発熱)を除き、300mg投与時に発現した。
ブリニューラ®に関する資材
ブリニューラ®に関するお問い合わせ
弊社製品についてのお問い合わせは下記「お問い合わせフォーム」または「会員に関するお問い合わせ」よりご連絡ください。
検査キット
セロイドリポフスチン症2型(CLN2)が疑われる方の診断に使用いただける検査キットをご提供しています。


