遺伝子組換えムコ多糖症ⅣA型治療剤
ビミジム®
ビミジム®(エロスルファーゼ アルファ)は、ムコ多糖症ⅣA型(MPS IVA、モルキオ症候群A型)に対する酵素補充療法製剤です。

ビミジム®の概要
ビミジム®はムコ多糖症ⅣA型(MPS IVA、モルキオ症候群A型)に対する酵素補充療法製剤です。
承認情報
- 承認
- 年月日
- 希少疾病用医薬品指定年月日
- 2012年12月11日(指定番号:第295号)
- 製造販売承認年月日
- 2014年12月26日
- 販売開始(薬価収載)年月日
- 2015年4月23日
効能又は効果
ムコ多糖症IVA型
用法及び用量
通常、エロスルファーゼ アルファ(遺伝子組換え)として、1回体重1㎏あたり2㎎を週1回、点滴静注する。
用法及び用量に関連する注意
1日局生理食塩液で希釈した後に投与すること。
下表を参考に投与速度は患者の状態を確認しながら徐々に上げ、注入ポンプを用いて本剤2㎎/㎏を約4時間以上(25㎏未満:3.6時間以上、25㎏以上:4.3時間以上)かけて静注すること。
- 体重範囲
- 25㎏未満
- 25㎏以上
- 薬液総量
- 100㎖
- 250㎖
- 投与開始~15分
- 3㎖/時
- 6㎖/時
- 15~30分
- 6㎖/時
- 12㎖/時
- 30~45分
- 12㎖/時
- 24㎖/時
- 45~60分
- 18㎖/時
- 36㎖/時
- 60~75分
- 24㎖/時
- 48㎖/時
- 75~90分
- 30㎖/時
- 60㎖/時
- 90分以降
- 36㎖/時
- 72㎖/時
本剤の投与によりinfusion reaction(頭痛、悪心、嘔吐、発熱、悪寒、腹痛等)が発現することがある。
これらの症状を軽減させるため、抗ヒスタミン剤を単独又は解熱鎮痛剤との併用で本剤投与開始30~60分前に前投与すること。
ビミジム®の作用機序
-
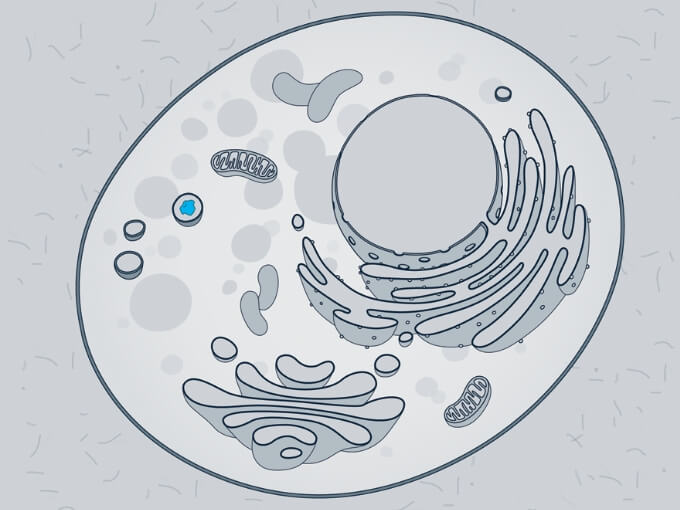
MPSIVAの原因は、重要なライソゾーム酵素であるN-アセチルガラクトサミン-6-スルファターゼ(GALNS)の遺伝的欠損である。 -
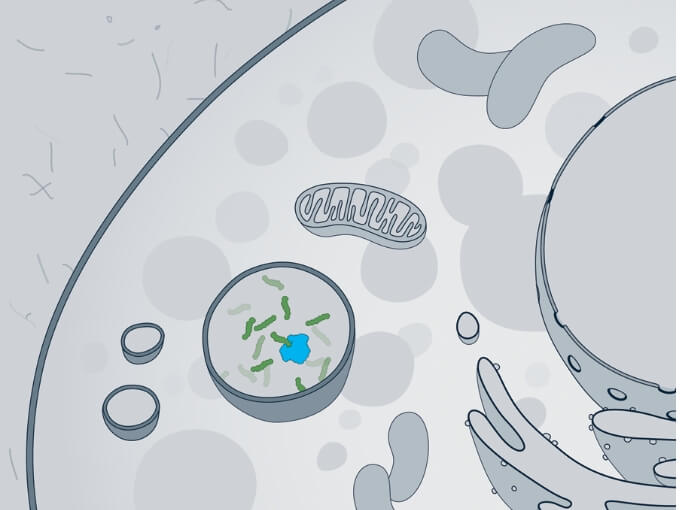
GALNSはGAGの異化に関与する。 -
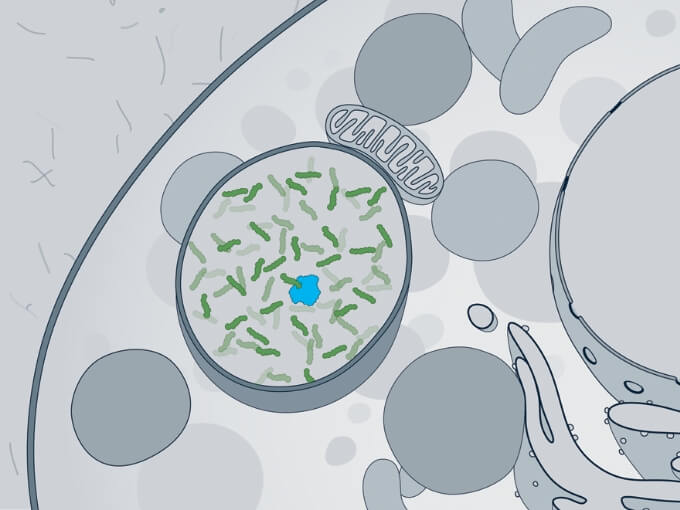
MPS IVAでは、GALNSの酵素活性欠損のため、全身でライソゾームにGAGが蓄積し、細胞・臓器系の機能障害がもたらされる。 -
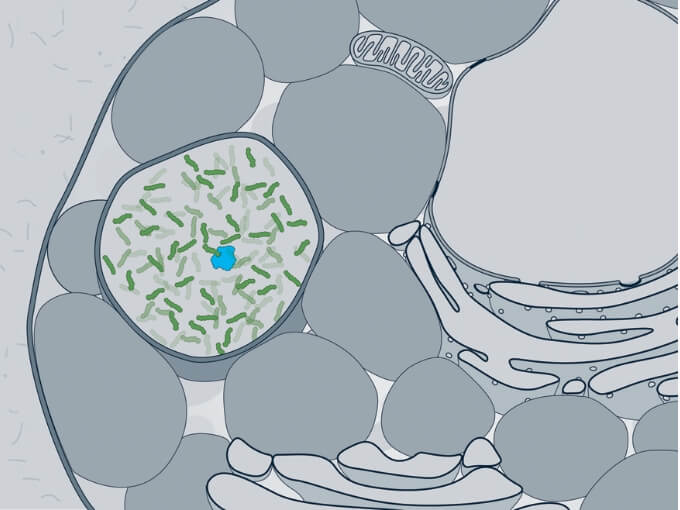
細胞レベルでは、GAGの蓄積によりライソゾームの膨れ、細胞質内の小器官密集が生じ、細胞機能が著しく妨げられ、二次的な発病カスケードが活性化される。 -
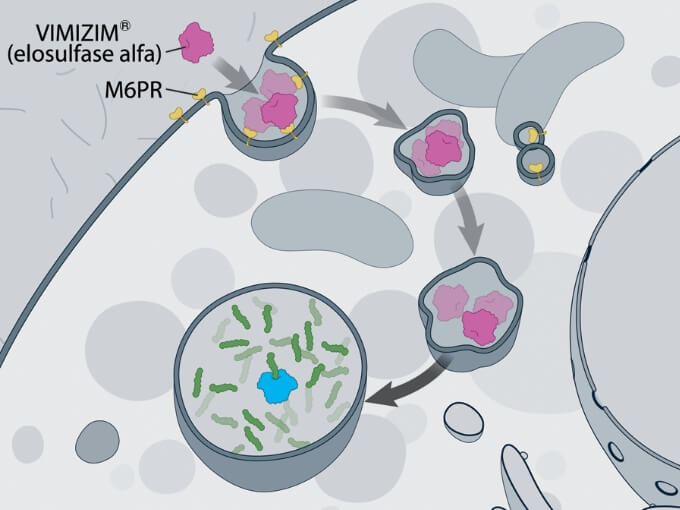
ビミジム®(エロスルファーゼアルファ)は外因性遺伝子組換えヒトGALNS酵素であり、マンノース-6-リン酸受容体への結合を介してライソゾームに取り込まれる。 -
ライソゾーム内で、ビミジム®はGAGの異化を増加させ、細胞機能を回復させる。
ビミジム®の特徴
- ムコ多糖症IVA型患者176例(プラセボ投与群59例、ビミジム®2㎎/㎏/週 投与群58例〔日本人2例〕、ビミジム®2㎎/㎏/隔週 投与群59例〔日本人4例〕)を対象としたプラセボ対照二重盲検試験(年齢範囲:5~57歳)を実施した。
全患者に対して抗ヒスタミン薬を前投与した。必要に応じて、解熱薬、副腎皮質ホルモン剤を投与した。
ビミジム®2㎎/㎏/週 投与群では、24週目にプラセボ群と比較して6分間歩行試験(6MWT)の歩行距離に有意な改善が認められた。 - Infusion reactionが、本剤の投与中又は投与終了翌日までに発現することがある。
臨床試験で認められた主な症状は頭痛、悪心、嘔吐、発熱、悪寒及び腹痛であった。
Infusion reactionが発現した場合には、その重症度により投与速度を下げるか、投与を一旦中止し、適切な薬剤治療(抗ヒスタミン剤、解熱剤又は副腎皮質ホルモン剤の投与)や緊急処置を行うこと。
重度のinfusion reactionが発現した場合には、本剤の投与を直ちに中止し、適切な処置を行い、本剤投与の再開については、有益性と危険性を考慮し決定すること。 - 重大な副作用として重篤なinfusion reaction(本剤投与中又は投与終了翌日までに発現する反応)(5.4%)があらわれることがある。
主な副作用(10%以上)として発熱、悪寒、疲労、頭痛、嘔吐、悪心、下痢、腹痛、上部腹痛、口腔咽頭痛が報告されている。
添付文書の副作用の項及び臨床成績の項の安全性を参照すること。
詳細は添付文書をご参照ください。
ビミジム®に関する資材
ビミジム®に関するお問い合わせ
弊社製品についてのお問い合わせは下記「お問い合わせフォーム」または「会員に関するお問い合わせ」よりご連絡ください。


