遺伝子組換えムコ多糖症VI型治療剤
ナグラザイム®
ナグラザイム®(ガルスルファーゼ)は、ムコ多糖症Ⅵ型(マロトー・ラミー症候群)に対する酵素補充療法製剤です。

ナグラザイム®の概要1
ナグラザイム®は、ムコ多糖症Ⅵ型(MPS Ⅵ、N-アセチルガラクトサミン-4-スルファターゼ欠損症、マロトー・ラミー症候群)に対する酵素補充療法製剤です。
承認情報
- 承認
- 年月日
- 希少疾病用医薬品指定年月日
- 2007年6月5日(指定番号:第201号)
- 製造販売承認年月日
- 2008年3月28日
- 販売開始(薬価収載)年月日
- 2008年4月14日
効能又は効果
ムコ多糖症VI型
用法及び用量
通常、ガルスルファーゼ(遺伝子組換え)として、1回体重1㎏あたり1㎎を週1回、点滴静注する。
用法及び用量に関連する注意
日局生理食塩液で希釈した後に投与すること。本剤の投与は注入ポンプを用いて、総量を4時間以上かけて投与すること。
投与速度は、体重が20㎏以下の患者の場合、初めの1時間は3㎖/時とし忍容性が良好なら38㎖/時に投与速度を上げ、投与を終了する。
体重が20㎏を超える患者の場合は、初めの1時間は6㎖/時とし忍容性が良好なら80㎖/時に投与速度を上げ、投与を終了する。
本剤の投与によりinfusion reaction(発熱、頭痛、発疹等)が発現する可能性がある。
これらの症状発現の予防及び発現時の症状を軽減させるために、抗ヒスタミン剤、解熱鎮痛剤又はその両方を本剤投与開始の30~60分前に前投与することが望ましい。
製剤写真
順次公開予定です。今しばらくお待ちください。
ナグラザイム®の作用機序2
ナグラザイム®は、ムコ多糖症Ⅵ型の病因であるASB活性の低下を補い、GAGの蓄積を改善する。
ナグラザイム®は、オリゴ糖鎖部分のマンノース-6-リン酸を介してマンノース-6-リン酸受容体と特異的に結合し、細胞内に取り込まれ、ライソゾーム内に蓄積されているGAGを分解する。
-
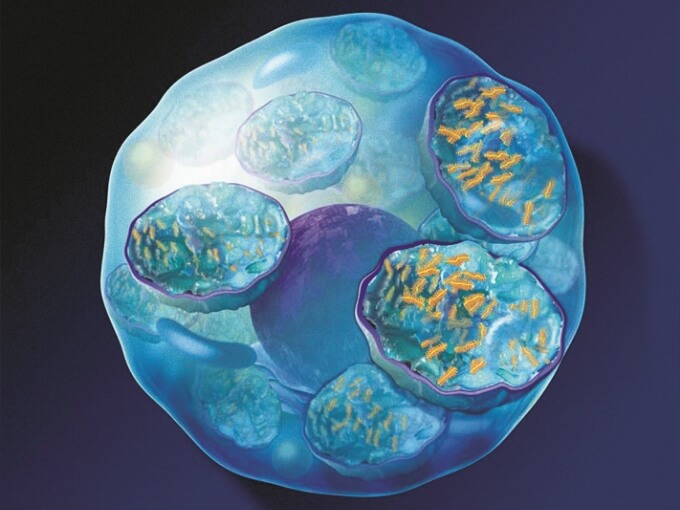
ライソゾーム内にGAGが蓄積されている -
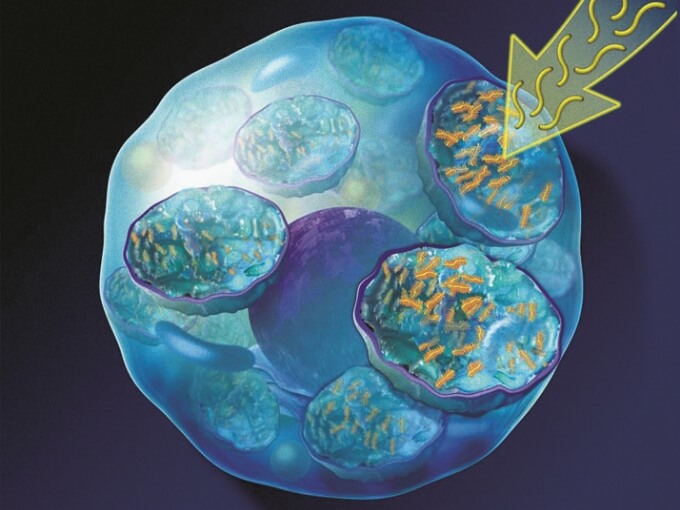
ナグラザイム®投与後に酵素活性が上昇する -
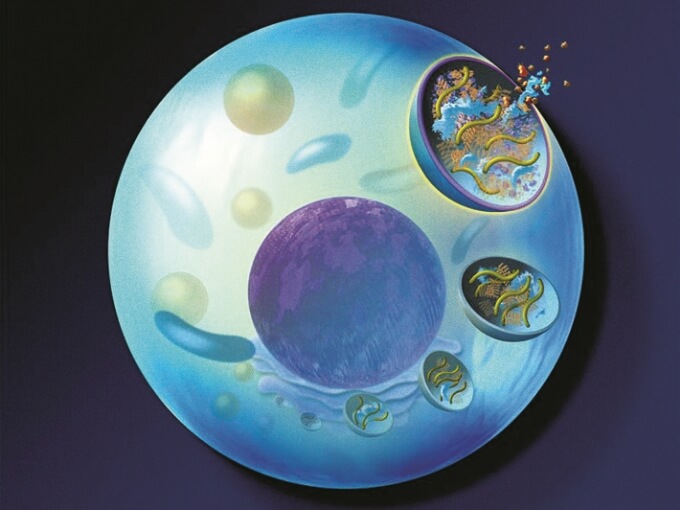
GAGの分解が促進される
ナグラザイム®の特徴3
- ナグラザイム®はヒトアリルスルファターゼBの遺伝子組換え製剤であり、日本で初めて承認されたムコ多糖症Ⅵ型に対する酵素補充療法製剤である。
- ナグラザイム®を週1回点滴静注することにより、ライソゾーム内に蓄積しているグリコサミノグリカン(GAG)を分解する。
- ナグラザイム®の24週間の週1回点滴静注により、12分間歩行試験において、ナグラザイム®投与群はプラセボ投与群と比較して、歩行距離が92m増加し、有意な改善を示した(p=0.025)。
3分間階段昇段試験において、ナグラザイム®投与群はプラセボ投与群と比較して、昇段速度が5.7段/分改善した(p=0.053)。 - 外国における臨床試験において、本剤を投与された患者54例中53例(98%)で抗ガルスルファーゼIgG抗体の発現が認められた。
抗体の最初の発現時期は、ほとんどが投与4~8週後であった。なお、抗体発現と尿中GAG濃度の間に関連性は認められなかった。
抗体レベルが高値であった患者5例では、薬物動態指標に顕著な差が認められた(4例でAUC低下、1例でAUC上昇)。 - 重大な副作用として、重度のアナフィラキシー様反応(呼吸困難等)、ネフローゼ症候群(膜性腎症等)があらわれることがある。
主な副作用(5%以上)として発熱、悪寒、胸痛、注入部位疼痛、頭痛、発疹、蕁麻疹、そう痒症、丘疹、紅斑、腹痛、嘔吐、悪心、低血圧、高血圧、呼吸困難、咳嗽、結膜炎が報告された。
添付文書の副作用の項及び臨床成績の項の安全性の結果を参照のこと。
詳細は添付文書、総合製品情報概要をご参照ください。
ナグラザイム®に関する資材
ナグラザイム®に関するお問い合わせ
弊社製品についてのお問い合わせは下記「お問い合わせフォーム」または「会員に関するお問い合わせ」よりご連絡ください。


