軟骨無形成症治療薬
ボックスゾゴ®
ボックスゾゴ®は軟骨無形成症の病態生理に則した作用機序で、持続的に骨の成長を促す薬剤です。
*ログイン後患者様の身長データの入力・グラフの出力ができます

ボックスゾゴ®の概要
ボックスゾゴ®は軟骨無形成症(ACH)の病態生理に基づき軟骨内骨化を促進させることにより、持続的に効果を発揮し、ACH患者さんの骨形成を促進する薬剤です。
承認情報
- 承認
- 年月日
- 希少疾病用医薬品指定年月日
- 2021年8月24日(指定番号:第521号)
- 製造販売承認年月日
- 2022年6月20日
- 販売開始(薬価収載)年月日
- 2022年8月25日(薬価収載:2022年8月18日)
効能又は効果
骨端線閉鎖を伴わない軟骨無形成症
用法及び用量
通常、ボソリチド(遺伝子組換え)として、2歳以上の患者には15㎍/㎏を、2歳未満の患者には30㎍/㎏ を1日1回、皮下注射する。
ただし、1回投与量は1㎎を超えないこと。
投与方法
患者の体重別投与量については下記の「ボックスゾゴ®投与にあたって」をご覧ください。
ボックスゾゴ®は在宅自己注射可能な薬剤です。
自己注射にあたっては投与法について十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導の下で実施してください。
有効性
小児ACH患者において、年間成長速度、及び身長Zスコアの改善が認められました。(111-301試験)
- 目的
- 軟骨無形成症(ACH)小児患者を対象に、ボックスゾゴ®連日皮下投与の有効性及び安全性を評価する
- 対象
- 5歳以上18歳未満のACH小児患者121例(日本人7例を含む)
- 試験方法
- ボックスゾゴ®群(15㎍/㎏)又はプラセボ群に1:1の割合で無作為割り付けし、1日1回52週間皮下投与した
- 主要評価項目
- 52週時の年間成長速度のベースラインからの変化量
- 副次評価項目
- 52週時の身長Zスコアのベースラインからの変化量、52週時の上体と下体の身体比率のベースラインからの変化量
■111-301試験:国際共同、多施設、無作為化、二重盲検、プラセボ対照、第Ⅲ相試験
- 主要評価項目である年間成長速度のベースラインから投与52週時までの変化量について、ボックスゾゴ®群のプラセボ群に対する優越性が示されました(p<0.0001、ANCOVA、両側p値)。
- 身長Zスコアのベースラインから投与52週時までの変化量について、ボックスゾゴ®群のプラセボ群に対する優越性が示されました(p<0.0001、ANCOVA、両側p値)。
小児ACH患者において、5年間にわたる有効性の持続性が示されました。(111-202/205試験)
- 目的
- 軟骨無形成症(ACH)小児患者を対象に、ボックスゾゴ®連日皮下投与の安全性及び忍容性を評価する
- 対象
- 5~14歳のACH小児患者35例(日本人1例を含む)
- 試験方法
- 用量設定期間(6ヵ月):患者をコホート1~4に順次登録し、ボックスゾゴ®2.5㎍/㎏(コホート1)、7.5㎍/㎏(コホート2)、15㎍/㎏(コホート3)、又は30㎍/㎏(コホート4)を1日1回、皮下投与した
継続投与期間(任意18ヵ月):年間成長速度の用量依存的な増加に基づき、コホート1又は2の患者は15㎍/㎏に増量し、コホート3又は4の患者は初回用量を継続した - 主要評価項目
- 安全性(有害事象など)
- 副次評価項目
- 年間成長速度のベースラインからの変化量、身長Zスコアのベースラインからの変化量 など
■111-202試験:国際共同、多施設、非盲検、連続コホート、用量漸増、第Ⅱ相試験
- 60ヵ月時までの全投与期間にわたって、ベースラインから統計学的に有意な年間成長速度の改善が認められました(p<0.95、対応のあるt検定)。
-
小児ACH患者の5年後の身長増加は、未治療のACH患者※と比較して統計学的に有意な差が認められました(p=0.0002、両側p値)。
※ACHの自然経過観察研究:ACH患者の成長(身長、身長速度、体重、BMI)の調査を目的とした医師主導のレトロスペクティブ多施設共同試験
安全性
主な副作用(10%以上)として、低血圧、嘔吐、注射部位反応、血中アルカリホスファターゼ増加が報告されています。
詳細は添付文書の「11.副作用」の項と「17.臨床成績」の安全性の結果をご覧ください。
- 10%以上
- 10%未満
- 神経系障害
- 失神
失神寸前の状態
浮動性めまい - 血管障害
- 低血圧
- 胃腸障害
- 嘔吐(27%)
- 悪心
- 全身障害及び投与部位の状態
- 注射部位反応(85%)
- 疲労
- 臨床検査
- 血中アルカリホスファターゼ増加
製剤写真
-

「ボックスゾゴ®皮下注用0.4㎎/0.56㎎/1.2㎎」外箱・日局注射用水・バイアル
ボックスゾゴ®の作用機序1,2)
- 軟骨無形成症は、線維芽細胞増殖因子受容体3(FGFR3)遺伝子の機能獲得型変異によって、FGFR3下流のシグナル伝達(MAPK経路)が異常に活性化され、成長板における軟骨細胞の増殖と分化が過剰に抑制される。その結果、軟骨内骨化の障害が起きる。
- ボックスゾゴ®は内在性のナトリウム利尿ペプチドC(CNP)の類縁体で、CNPより長い半減期を有する。
- ボックスゾゴ®はナトリウム利尿ペプチド受容体B(NPR-B)に結合し、FGFR3の下流のシグナル伝達(MAPK経路)を拮抗的に阻害する。その結果、軟骨内骨化による骨形成を促進する。
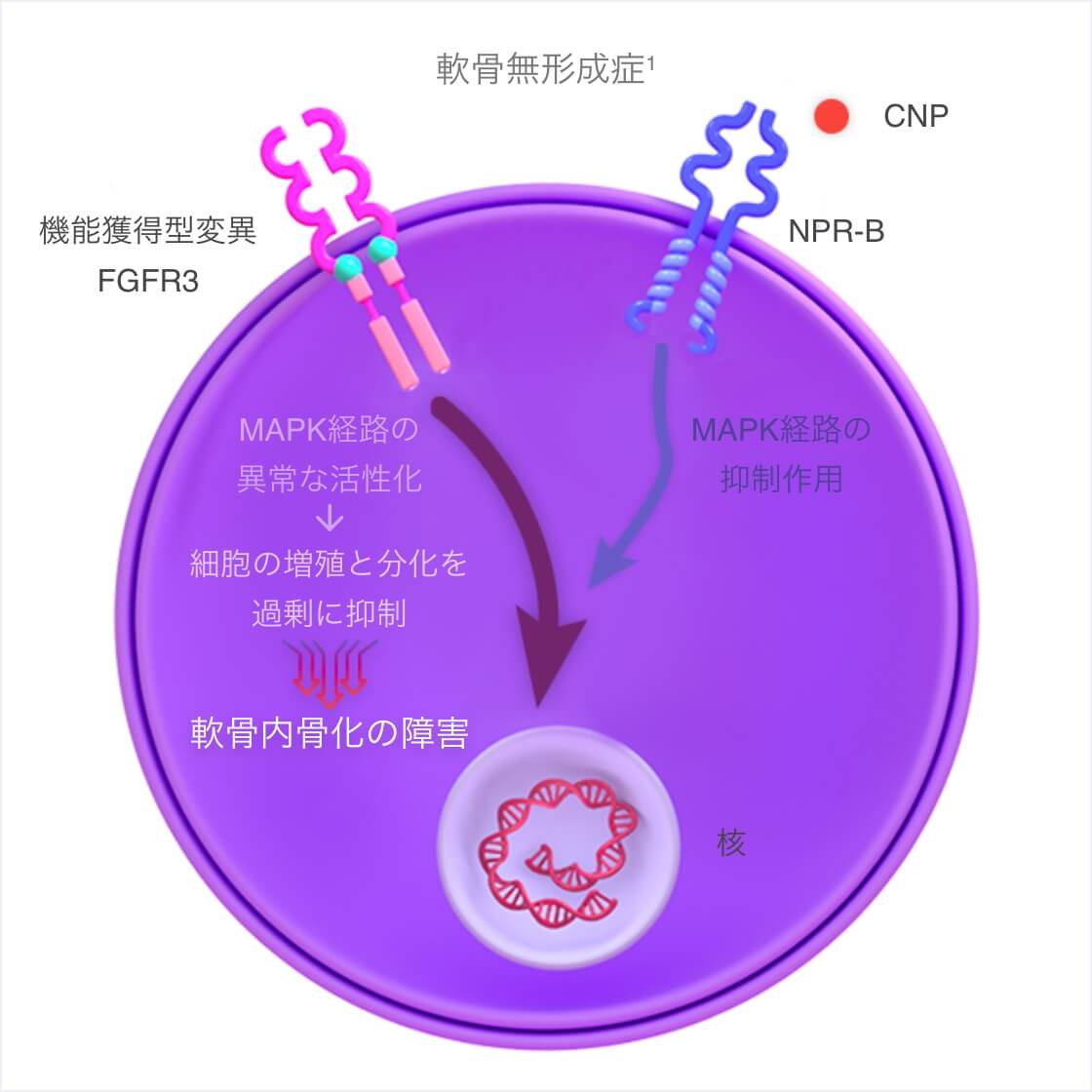
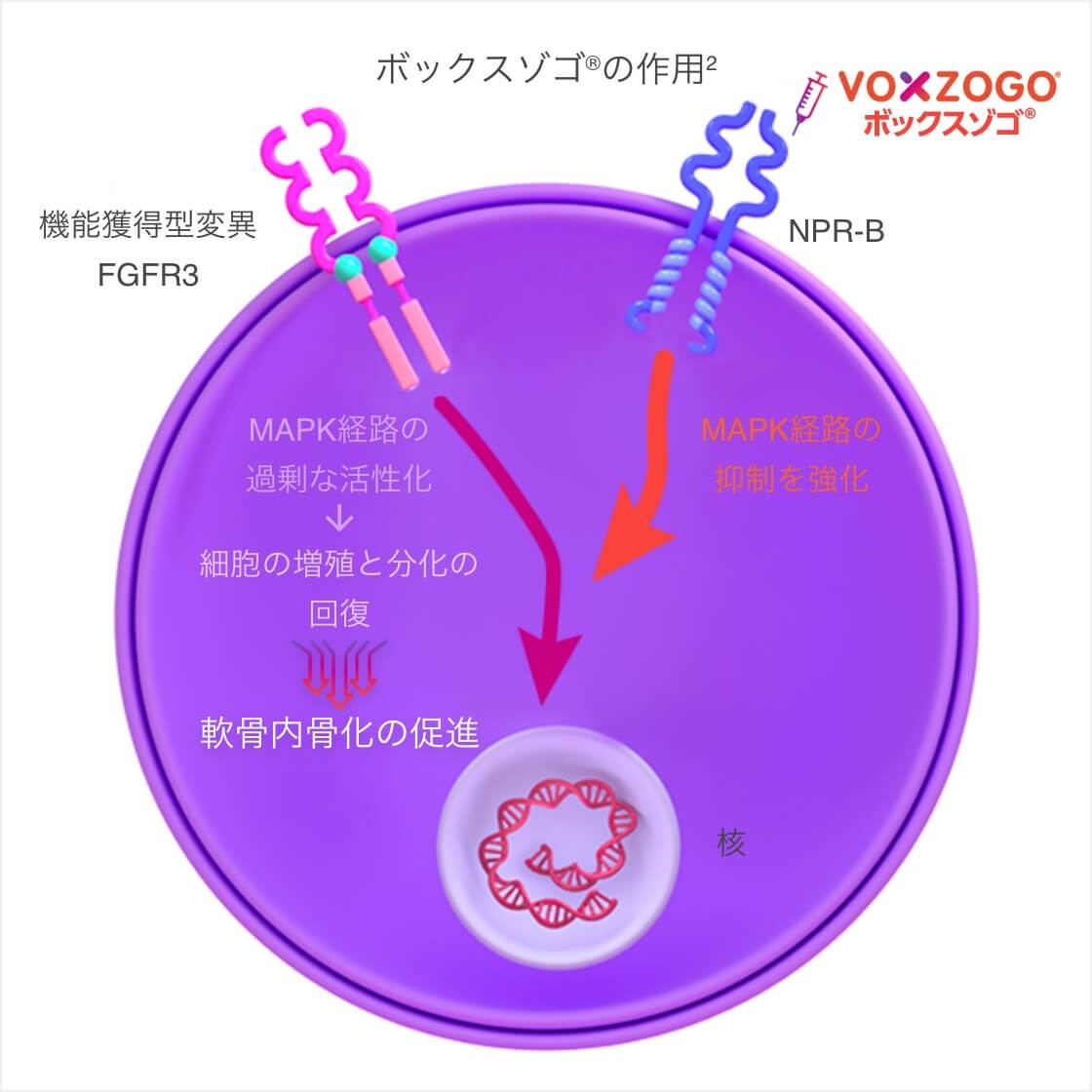
CNP:C型ナトリウム利尿ペプチド、FGFR3:線維芽細胞増殖因子受容体3、NPR-B:ナトリウム利尿ペプチド受容体B
Achondroplasia&Vosoritide解説動画
軟骨無形成症の病態とボックスゾゴ®(一般名:ボソリチド)のメカニズムについてCGなどを用いてご紹介しています。
(日本語字幕付き)

ボックスゾゴ®投与にあたって
用法及び用量に関連する注意
- 本剤は1日1回投与する薬剤であり、可能な限り同一時間帯に投与すること。
- 本剤の投与を忘れた場合は、次回投与までの期間が12時間以上であれば気づいた時点で投与し、その後はあらかじめ定めた時間帯に投与すること。次回投与までの期間が12時間未満であれば投与せず、次のあらかじめ定めた時間帯に投与すること。
- 2歳以上の患者
- 2歳未満の患者
-
2歳以上の患者には、下表を参考に投与量を決定し、投与すること。
- 製品名
-
ボックスゾゴ®
皮下注用
0.4㎎ -
ボックスゾゴ®
皮下注用
0.56㎎ -
ボックスゾゴ®
皮下注用
1.2㎎ - 溶解後液量
- 0.5㎖
- 0.7㎖
- 0.6㎖
- 溶解後濃度
- 0.8㎎/㎖
- 0.8㎎/㎖
- 2.0㎎/㎖
- 採取可能量
- 0.3㎖
- 0.5㎖
- 0.4㎖
- 患者さんの体重(㎏)
- 投与量(㎖)
- 8~9㎏
- 0.15㎖
- -
- -
- 10~11㎏
- 0.20㎖
- -
- -
- 12~14㎏
- 0.25㎖
- -
- -
- 15~17㎏
- 0.30㎖
- -
- -
- 18~19㎏
- -
- 0.35㎖
- -
- 20~22㎏
- -
- 0.40㎖
- -
- 23~25㎏
- -
- 0.45㎖
- -
- 26~27㎏
- -
- 0.50㎖
- -
- 28~29㎏
- -
- -
- 0.20㎖
- 30~36㎏
- -
- -
- 0.25㎖
- 37~43㎏
- -
- -
- 0.30㎖
- 44~49㎏
- -
- -
- 0.35㎖
- 50~56㎏
- -
- -
- 0.40㎖
- 57~63㎏
- -
- -
- 0.45㎖a)
- ≥64㎏
- -
- -
- 0.50㎖a)
a) 2バイアルを使用して投与量を採取する。
-
2歳未満の患者には、下表を参考に投与量を決定し、投与すること。
- 製品名
-
ボックスゾゴ®
皮下注用
0.4㎎ -
ボックスゾゴ®
皮下注用
0.56㎎ - 溶解後液量
- 0.5㎖
- 0.7㎖
- 溶解後濃度
- 0.8㎎/㎖
- 0.8㎎/㎖
- 採取可能量
- 0.3㎖
- 0.5㎖
- 患者さんの体重(kg)
- 投与量(㎖)
- 3㎏
- 0.10㎖
- -
- 4㎏
- 0.15㎖
- -
- 5㎏
- 0.20㎖
- -
- 6~7㎏
- 0.25㎖
- -
- 8㎏
- 0.30㎖
- -
- 9㎏
- -
- 0.35㎖
- 10~11㎏
- -
- 0.40㎖
- 12㎏
- -
- 0.45㎖
- 13㎏
- -
- 0.50㎖
血圧低下に関連する注意
- 一過性の血圧低下や血圧低下に伴う症状(めまい、吐き気、疲労、失神等)があらわれることがあるので、本剤投与時には適切な水分補給を行うよう患者に指導すること。
- 一過性の血圧低下があらわれることがあるので、高所での作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
ボックスゾゴ®臨床試験一覧
- 試験
- 試験デザイン
- 試験の目的
- 対象
- 投与方法
- 投与期間
- 111-202試験
海外第Ⅱ相3,4,5 - 非盲検
連続コホート
用量漸増 - 安全性
忍容性 - 5~14歳の
ACH小児患者35例
(米国で試験に参加した日本人1例を含む) - 2.5、7.5、15
又は30㎍/㎏を
1日1回皮下投与 - 最長24ヵ月
(用量設定期間6ヵ月間と任意の継続期間18ヵ月) - 111-205試験
海外第Ⅱ相4,6 - 非盲検
111-202試験の継続試験 - 長期安全性
忍容性
有効性 - 111-202試験を完了した
ACH小児患者30例
(米国で試験に参加した日本人1例を含む) - 15又は30㎍/㎏を
1日1回皮下投与 - 5年
又は最終身長※に達するまでのいずれか遅い方 - 111-206試験
国際共同第Ⅱ相7 - 無作為
二重盲検
プラセボ対照 - 安全性
有効性 - 5歳未満のACH乳幼児患者75例
(日本人8例を含む) - 2~5歳未満:
15㎍/㎏を1日1回皮下投与
2歳未満:
30㎍/㎏を1日1回皮下投与 - 52週間
- 111-208試験
国際共同第Ⅱ相7 - 非盲検
111-206試験の継続試験 - 長期安全性
忍容性
有効性 - 111-206試験を完了した
ACH小児患者63例
(日本人8例を含む) - 2~5歳未満:
15㎍/㎏を1日1回皮下投与
2歳未満:
30㎍/㎏を1日1回皮下投与 - 最終身長※に達するまで
- 111-301試験
国際共同第Ⅲ相5,8 - 無作為化
二重盲検
プラセボ対照 - 有効性
安全性 - 5~18歳未満のACH小児患者121例
(日本人7例を含む) - 15㎍/㎏を1日1回皮下投与
- 52週間
- 111-302試験
国際共同第Ⅲ相9,10 - 非盲検
111-301試験の
継続試験 - 長期安全性
忍容性
有効性 - 111-301試験を完了した
ACH小児患者119例
(日本人6例を含む) - 15㎍/㎏を1日1回皮下投与
- 5年
又は最終身長※に達するまでのいずれか遅い方
※最終身長:骨端線の閉鎖が画像検査によって確認され、かつ6ヵ月ごとの年間成長速度が1.5cm/年未満と定義
ボックスゾゴ®の有効性(111-301試験:国際共同第Ⅲ相試験)
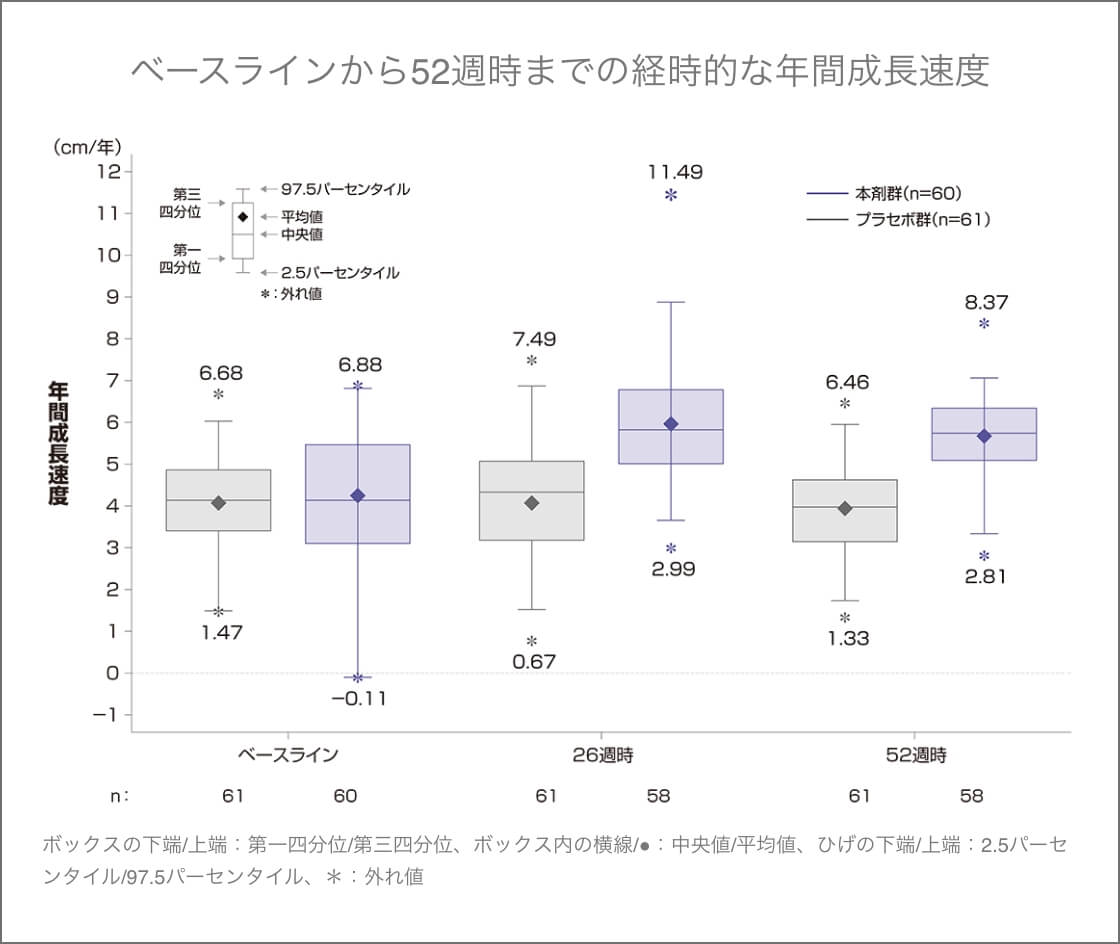
年間成長速度
52週時の年間成長速度のベースラインからの変化量(最小二乗平均)は、ボックスゾゴ®群1.71 cm/年、プラセボ群0.13 cm/年、両群の差は1.57 cm/年(95%CI:1.22~1.93、p<0.0001、ANCOVA)であり、ボックスゾゴ®群のプラセボ群に対する優越性が検証された。
111-301試験の概要
【目的】ボックスゾゴ®の有効性及び安全性を検証する
【対象・方法】5歳以上18歳未満の軟骨無形性症患者121例(日本人7例を含む)を、ボックスゾゴ®群(15㎍/㎏)とプラセボ群に1:1の割合でランダムに振り分け、1日1回52週間皮下投与した。
【試験期間】初回登録日:2016年12月12日、最終投与日:2019年10月30日
52週時の年間成長速度の
ベースラインからの変化量(FAS)
(主要評価項目)
- ボックスゾゴ®群(n=60)1
- プラセボ群(n=61)
- ベース
ライン - 52週時
- ベース
ライン - 52週時
- 年間成長速度(cm/年)
[平均値(SD)] - 4.26
(1.53) - 5.61
(1.05) - 4.06
(1.20) - 3.94
(1.07) - ベースラインからの変化量(cm/年)
最小二乗平均(95%CI) - 1.71
(1.40~2.01) - 0.13
(-0.18~0.45) - ベースラインからの変化量の群間差(cm/年)
最小二乗平均(95%CI)p値 - 1.57(1.22~1.93)
p<0.0001*2
FAS:最大の解析対象集団、SD:標準偏差
*1 52週までに試験を中止した2例のデータを補完した。
*2 ANCOVA
ボックスゾゴ®の安全性(111-301試験:国際共同第Ⅲ相試験)
- 治験薬と関連のある有害事象は、ボックスゾゴ®群53/60例(88.3%)、プラセボ群51/61例(83.6%)に認められ、主な事象は、ボックスゾゴ®群で注射部位反応43例(71.7%)、注射部位紅斑41例(68.3%)、注射部位腫脹23例(38.3%)、プラセボ群で注射部位紅斑39例(63.9%)、注射部位反応28例(45.9%)、注射部位内出血、注射部位出血が各7例(11.5%)であった。
- 重篤な有害事象は、ボックスゾゴ®群で3例(インフルエンザ、橈骨骨折、アデノイド肥大・睡眠時無呼吸症候群)、プラセボ群で4例(虫垂炎、アデノイド肥大、呼吸困難、頭蓋内圧上昇・脊髄圧迫)に認められ、いずれも治験薬と関連なしと判定された。
- 投与中止に至った有害事象は、ボックスゾゴ®群で1例(処置による不安)に認められた。死亡例は認められなかった。
治験薬と関連のある有害事象(10%以上)11
- ボックスゾゴ®群(n=60)
- プラセボ群(n=61)
- n(%)
- 治験薬と関連のある有害事象発現例数
- 53(88.3)
- 51(83.6)
- 注射部位反応
- 43(71.7)
- 28(45.9)
- 注射部位紅斑
- 41(68.3)
- 39(63.9)
- 注射部位腫脹
- 23(38.3)
- 6(9.8)
- 注射部位蕁麻疹
- 7(11.7)
- 2(3.3)
- 注射部位内出血
- 5(8.3)
- 7(11.5)
- 注射部位出血
- 1(1.7)
- 7(11.5)
- 血圧低下
- 7(11.7)
- 3(4.9)
MedDRA/J version 22.0
ボックスゾゴ®に関する資材
ボックスゾゴ®に関するお問い合わせ
弊社製品についてのお問い合わせは下記「お問い合わせフォーム」または「会員に関するお問い合わせ」よりご連絡ください。


